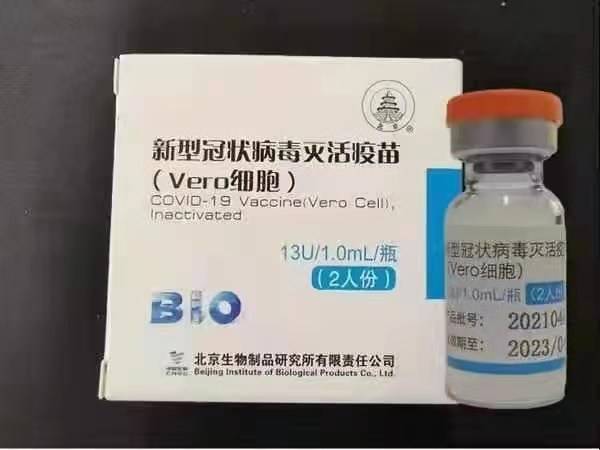
Sinopharm (Beijing): BBIBP-CorV
FASA 1
1 Percubaan
ChiCTR2000032459
China
FASA 2
2 Percubaan
NCT04962906
Argentina
ChiCTR2000032459
China
FASA 3
6 Percubaan
NCT04984408
ChiCTR2000034780
Emiriah Arab Bersatu
NCT04612972
Peru
NCT04510207
Bahrain, Mesir, Jordan, Emiriah Arab Bersatu
NCT04560881, BIBP2020003AR
Argentina
NCT04917523
Emiriah Arab Bersatu
Kelulusan
Penyenaraian Penggunaan Kecemasan WHO 59 Negara
Angola 、 Argentina 、 Bahrain 、 Bangladesh 、 Belarus 、 Belize 、 Bolivia (Negara Plurinasional) 、 Brazil 、 Brunei Darussalam 、 Kemboja 、 Kamerun 、 Chad 、 China 、 Komoro 、 Mesir Gu Guinea Khatulistiwa 、 Gabon 、 Gambia 、 Georgia 、 Guyana 、 Hungaria 、 ndonesia 、 Iran (Republik Islam) 、 Iraq 、 Jordan 、 Kyrgyzstan Republic Republik Demokratik Rakyat Laos
Lebanon 、 Malaysia 、 Maldives 、 Mauritania 、 auritius 、 Mongolia 、 Montenegro 、 Morocco 、 Mozambique 、 Namibia 、 Nepal 、 Niger Maced Macedonia Utara 、 Pakistan 、 Paraguay 、 Peru 、 Filipina 、 Republik Kongo 、 enegal 、 Serbia 、 Seychellone 、 Kepulauan 、 Somalia 、 Sri Lanka 、 Thailand 、 Trinidad dan Tobago 、 Tunisia Emirates Emiriah Arab Bersatu 、 Venezuela (Republik Bolivarian) 、 Vietnam 、 Zimbabwe
Sinopharm BBIBP-CorV COVID-19 adalah vaksin yang tidak aktif yang terbuat dari zarah virus yang tumbuh kultur yang tidak mempunyai kemampuan patogen. Calon vaksin ini dikembangkan oleh Sinopharm Holdings dan Institut Produk Biologi Beijing.
Vaksin Sinopharm BBIBP-CorV berfungsi dengan membenarkan sistem imun menghasilkan antibodi terhadap koronavirus beta SARS-CoV-2. Vaksin virus yang tidak aktif telah digunakan selama beberapa dekad, seperti vaksin rabies dan vaksin hepatitis A. Teknologi pengembangan ini telah berjaya diterapkan pada banyak vaksin terkenal, seperti vaksin rabies.
Strain SARS-CoV-2 Sinopharm (strain WIV04 dan nombor perpustakaan MN996528) diasingkan dari seorang pesakit di Hospital Jinyintan di Wuhan, China. Virus ini disebarkan dalam kultur dalam garis sel Vero yang kompeten, dan supernatan sel yang dijangkiti tidak aktif dengan β-propiolactone (1: 4000 vol / vol, 2 hingga 8 ° C) selama 48 jam. Selepas penjelasan mengenai serpihan sel dan ultrafiltrasi, inaktivasi β-propiolakton kedua dilakukan dalam keadaan yang sama dengan inaktivasi pertama. Menurut WHO, vaksin itu diserap ke dalam 0,5 mg tawas dan dimasukkan ke dalam jarum suntikan dalam 0.5 mL garam steril tanpa fosfat steril tanpa bahan pengawet.
Pada 31 Disember 2020, Pentadbiran Dadah Negeri mengumumkan persetujuan vaksin eksperimen yang dikembangkan oleh Sinopharm.
Pada 7 Mei 2021, Pertubuhan Kesihatan Sedunia mengumumkan persetujuan vaksin. Senarai penggunaan kecemasan WHO membolehkan negara mempercepat kelulusan peraturan mereka sendiri untuk mengimport dan mentadbir vaksin COVID-19. Kumpulan Pakar Penasihat WHO mengenai Strategi Imunisasi juga telah menyelesaikan kajian vaksinnya. Berdasarkan semua bukti yang ada, WHO mengesyorkan dua dos vaksin, tiga hingga empat minggu, untuk orang dewasa 18 tahun ke atas. Keberkesanan vaksin terhadap penyakit simptomatik dan dimasukkan ke hospital dianggarkan 79% untuk semua kumpulan umur.
Persatuan Perubatan Amerika menerbitkan "Percubaan Klinikal Rawak: Kesan 2 Vaksin SARS-CoV-2 yang Tidak Aktif pada Jangkitan COVID-19 Simptomatik pada Orang Dewasa" pada 26 Mei 2021, menyimpulkan bahawa "dalam analisis interim yang ditentukan dari percubaan klinikal rawak ini, dewasa 2 vaksin SARS-CoV-2 yang tidak aktif yang diberikan dalam analisis interim yang ditentukan dari ujian klinikal rawak ini secara signifikan mengurangkan risiko COVID-19 simptomatik, dan kejadian buruk yang serius jarang terjadi. " Dalam percubaan rawak fasa 3 ini pada orang dewasa, keberkesanan 2 vaksin virus keseluruhan yang tidak aktif dalam kes COVID-19 simptomatik masing-masing adalah 72.8% dan 78.1%. 2 vaksin mempunyai kejadian buruk serius yang jarang berlaku dengan kekerapan yang serupa dengan kumpulan kawalan tawas, dan kebanyakannya tidak berkaitan dengan vaksinasi. Analisis penerokaan mendapati bahawa 2 vaksin tersebut menyebabkan antibodi peneutralan yang dapat diukur, mirip dengan hasil percubaan fasa 1/2.
Kumpulan Kerja WHO SAGE menerbitkan tinjauan vaksin Sinopharm / BBIBP COVID-19 pada 10 Mei 2021. Vaksin GAVI COVID-19 menggabungkan monitor vaksin vaksin yang memberitahu pekerja kesihatan sama ada vaksin telah disimpan dengan betul dan belum terdedah kepada terlalu panas. Akibatnya, kerosakan, GAVI melaporkan pada 14 Mei 2021. label pintar yang dikeluarkan oleh Zebra Technologies dan dibuat oleh Temptime Corporation, terdiri daripada bulatan dengan kotak berwarna lebih terang di tengahnya, terbuat dari bahan kimia tidak berwarna yang dapat mengembangkan warna secara tidak berubah dari masa ke masa . Ini menjadi lebih gelap untuk memberi petunjuk visual pendedahan haba kumulatif. Setelah botol terkena haba melebihi jarak penyimpanan optimumnya, kotak menjadi lebih gelap daripada bulatan, yang menunjukkan bahawa vaksin tidak boleh digunakan lagi.
Nombor pendaftaran perpustakaan ubat vaksin Nasional BBIBP-CorV COVID-19: DB15807.